البحث عن الصيغة الجزيئية أو المولية هو عملية أساسية في مجال ا. إذ تساعد هذه العملية على تحديد كمية ونوع الذرات والروابط بينها في المركب الكيميائي. تحديد الصيغة الجزيئية أمر ضروري لفهم الخصائص والسلوك الكيميائي للمركبات. في هذا المقال، سنتناول الخطوات الرئيسية التي يمكن اتخاذها لإيجاد الصيغة الجزيئية أو المولية لمركب كيميائي.
شاهد ايضاً كيفية موازنة المعادلات الكيميائية 2023 .
سنتعرف في هذا الدرس إن شآءالله عن:
- مقدمة عامة عن الصيغ الكيميائية العامة
- العلاقة بين الصيغ التجريبية و الصيغة الجزيئية أو المولية
- كيفية حساب كتل وأوزان الذرات والجزيئات الداخلة في تركيب المركبات
- كيفية كتابة المركب بصورة رمزية كالصيغة الجزيئية أو المولية
- بعض النصائح والإرشادات والتحذيرات الهامة من أجل حل المسائل
- بعض النصائح والأفكار المفيدة والضرورية من أجل الامتحانات والاختبارات
- وكيفية إدارة الوقت فيها
- كيفية حساب عدد المولات من خلال العلاقات الكيميائية
- أمثلة متنوعة وتوضيحية
- خطوات حل المسائل وإيجاد الصيغ الكيميائية الجزيئية
- الأشياء والمعدات اللازمة للدراسة ولحل المسائل الكيميائية.
مقدمة عامة كيفية إيجاد الصيغة الجزيئية أو المولية
تعد الصيغة الجزيئية معلومة مهمة لأي مركب كيميائي حيث تعلمك الصيغة الجزيئية بالذرات الموجودة في المركب وعدد كل منها سيكون عليك أن تعرف الصيغة التجريبية لحساب الصيغة الجزيئية وأن تعرف أن الفرق بين الصيغتين هو مضاعف عدد صحيح.
كيفية اشتقاق الصيغة الجزيئية أو المولية من الصيغة التجريبية :
اعرف العلاقة بين الصيغتين الجزيئية والتجريبية:
ذرة كربون وذرتي أكسجين يشكلان بعد اتحادهما مع بعض غاز (ثاني أكسيد الكربون) وهذا الغاز موجود بكثرة في الطبيعة في الهواء مثلاً وهو أقرب مثال إلى الأهداف وخصوصاً هواء الزغير الذي يخرج من الرئتين بعد عملية الأكسجة ويمثل عملية الزفير لأنه يخرج عبر الأنف نحو الخارج إلى الهواء المحيط بنا.
مثلًا ترتبط الصيغتان الصيغة الجزيئية أو المولية والتجريبية المخبرية بنسبة تساوي عدد صحيح أي من مضاعفاتها أي نقوم بضربها بعدد ثابت لكل الصيغة بالتأكيد…بحيث لو ضربت الصيغة التجريبية في هذه النسبة أو بهذا العدد فسيكون الناتج هو الصيغة الجزيئية أو الصيغة المولية المطلوبة …
كيفية حساب عدد مولات الغاز :
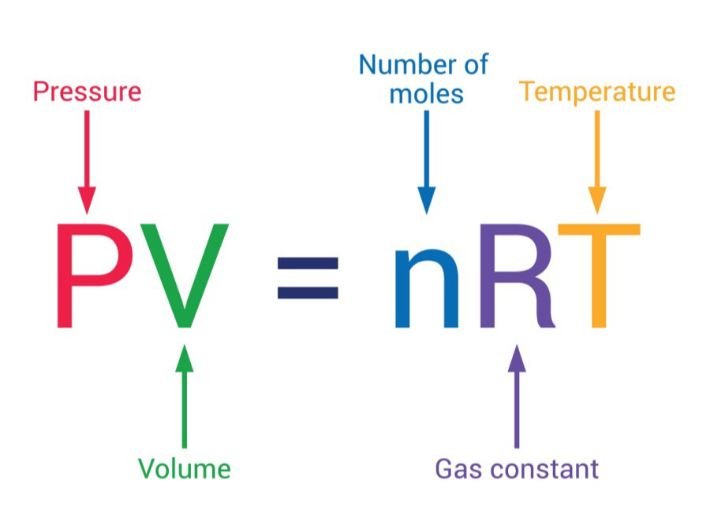
يعني هذا استخدام قانون الغازات المثالية الغير حقيقية : يمكنك تحديد عدد المولات بناءً على بعض المعاليم والمقادير وهي الضغط والحجم والحرارة المأخوذين من البيانات التجريبية أو البيانات المخبرية وسمي هذا الغاز بالماضي لأن صفاته وخواصه مثالية ولاتوجد في الطبيعة أبداً :
يمكن حساب عدد المولات باستخدام المعادلة أو العلاقة التالية: n = PV/RT وهو ما يعرف بقانون الغازات العام p.v=nRT الخاص بالغازات المثالية المطلقة
على سبيل المثال:
n = PV/RT = (0.984 atmosphere × 1 لتر ) / (0.08206 L atm مول -1 كلفن-1 × 318.15 كلفن) = 0.0377 مول
قمنا بتعويض أرقام فرضية مع وحدة كل رمز أو حد في هذا القانون
يجب حفظ ومراعاة كل وحدة من هذه الوحدات حسب المقدار الذي نتعامل معه مثل الضغط نستخدم له الوحدة atmosphere وتعني كلمة جو أي ضعطها عدد صحيح من عدد ضغط الجو ويمثل الضغط الجوي ١ atmosphere ونستطيع اختصار هذه الوحدة بالرمز atm .
كيفية حساب الوزن الجزيئي أو الوزن المولي للغاز المدروس وسوف نعتبره مثالي ومطلق

يمكن فعل هذا فقط بعد إيجاد عدد مولات الغاز المدروس باستخدام القانون العام للغازات المثالية ، كما ستحتاج لمعرفة عدد جرامات الغاز الموجودة أي معرفة كتلته أوزنه وكثافته ثم قسمة الجرامات على عدد المولات للحصول على الوزن الجزيئي أو الوزن المولي
على سبيل المثال:
14,42grجرام/ mol0,0377مول = 382,49 جرام/مول : mol/ gr
قم بجمع الوزن الذري لجميع الذرات في الصيغة التجريبية أو الصيغة المخبرية:
لكل ذرة في الصيغة التجريبية وزنٌ ذري ثابت ؛ يمكن إيجاد هذه القيمة أسفل مربع كل الذرة في الجدول الدوري الذي قام بإيجاده وترتيبها العالم مالديف ..
اجمع هذه الأوزان بعد استخراجها من الجدول الدوري أو من نص المسألة ومعطياتها مع بعضها البعض للحصول على وزن الصيغة التجريبية الكامل والكلي .
على سبيل المثال:
(12,0107 جرام × 12 أي عدد هذه الذرة في المركب ١٢ عدد ذرات العنصر لذلك نضرب الوزن الذري للذرة الواحدة بعدد الذرات والذي هو ١٢ ) + (15,9994 جرا م× 1 أي يوجد في المركب ذرة واحدة من هذا العنصر ) + (1,00794 جرام× 30) = 144,1284 + 15,9994 + 30,2382 = 190,366جرام.

جد النسبة بين أوزان الصيغة الجزيئية والتجريبية :
يمكنك بهذه الطريقة أن تحدد عدد مرات تكرار الوزن التجريبي في جزيء فعلي وعملي ؛ وستمكنك تعلم و معرفة ذلك من إيجاد عدد مرات تكرار الصيغة التجريبية لنفسها في الصيغة الجزيئية أو الصيغة المولية أي معرفة كم نسخة للصيغة التجريبية في الصيغة الجزيئية
يجب أن يكون هذا رقمًا صحيحًا ومنطقياً، أما إذا لم يكن الرقم كذلك فسيتوجب عليك تقريبه إلى عدد منطقي ومقبول
على سبيل المثال:
382,49/ 190,366 = 2,009 نستطيع تقريبه إلى ٢ لسهولة ولأن تآثيره على حل المسألة والنتيجة النهاية صغير وبسيط جداً
الآن قم بضرب الصيغة التجريبية التي وجدتها في النسبة المعطاة في نص المسألةأو التي قمت بحسابها وإيجادها :
اضرب الرقم أو الرمز السفلي للصيغة التجريبية في النسبة المذكورة في معطيات المسألة ، وهذا سينتج لك الصيغة الجزيئية المطلوبة …
لاحظ أن الصيغتان ستكونان متماثلتين لأي مركب نسبته “1” أي العدد الصحيح المضروب بالصيغة التجريبية هو العدد ١ لذلك تساوت الصيغتان .
على سبيل المثال
: C12OH30 × 2 = C24O2H60 نقوم بضرب العدد أو التناسب بكل الصيغة أي نعتبرها معادلة أو مجموعة حدود وندخل علبها العدد المضروب بها على كل حد أو عنصر ..
ثانياٍ: إيجاد الصيغة التجريبية :
عليك إيجاد كتلة ووزن كل ذرة من الذرات أولاً :
أحيانًا تكون كتلة كل ذرة معطاة في نص المسألة أو نقوم بإستخراجها من الجدول الدوري ، وفي أحيان أخرى ستعطى كنسبة مئوية أو كسرية من الكتلة افترض وجود عينة من المركب بكتلة 100 جرام لاحظ أن جميع الوحدات الكتلة والوزن في علم الكيمياء هي بالجرامات وذلك لأننا نتعامل مع كتل صغيرة جداً ويهمنا الدقة والموثوقية جداً في الإجابات والنتائج إذاً في هذه الحالة سيمكنك هذا ويساعدك كثيراً من كتابة النسبة المئوية للكتلة ككتلة فعلية بالجرامات
على سبيل المثال: لديك بعض الذرات مع أوزانها أو نسبها من الكتلة الكلية
75.46 جرام = C و8.43 جرام = O و16.11 جرام = H
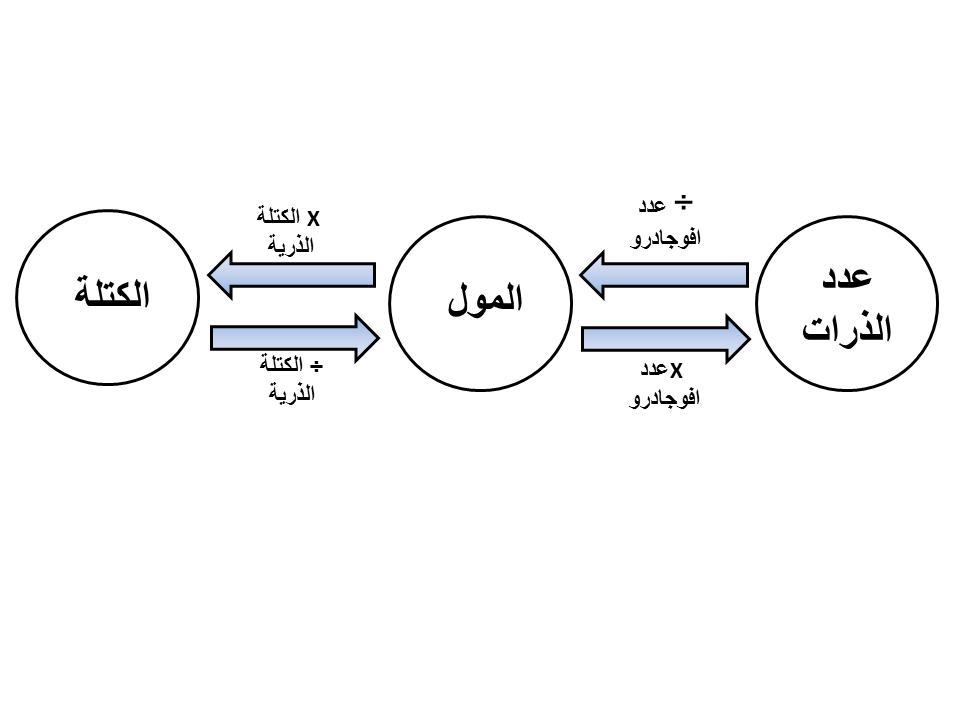
قم بتحويل الكتل إلى مولات :
عليك تحويل الكتل الصيغة الجزيئية أو المولية لكل عنصر إلى مولات، ولفعل ذلك عليك أن تقسم الكتل الجزيئية أو الكتل المولية لافرق ..على الكتل الذرية لكل عنصر من العناصر الموجودة في الصيغة . يمكنك إيجاد الكتلة الذرية أسفل مربع كل عنصر تريد حساب كتلته ووزنه في الجدول الدوري .
على سبيل المثال الصيغة الجزيئية أو المولية:
75.46 جرام C أي ذرة كربون × (1 مول / 12.0107 جرام) = 6.28 مول C من الكربون
8.43 جرام O ذرة أكسجين × (1 مول / 15.9994 جرام) = 0.53 مول Oمن الأوكسجين
16.11 جرام H ذرة هيدروجين × (1 مول / 1.00794 جرام) = 15.98 مول H من الهيدروجين
قم بتقسيم كل القيم المولية على أصغر قيمة بينها في الصيغة :
عليك أن تقسم عدد المولات لكل عنصر مستقل من عناصر الصيغة على أصغر مقدار مولي وجزيئي من العناصر الموجودة في هذا المركب يمكنك بهذه الطريقة أو بهذا الإسلوب من الحل إيجاد أبسط النسب المولية والجزيئية ينجح هذا لأنه يجعل أقل العناصر والجزيئات توافرًا بالعدد “1” ويعطي النسب المناظرة للعناصر الأخرى بالمركب مما يسهل كثيراً في العمليات الحسابية إيجاد الصيغة العامة وحساب الأوزان المطلوبة.
على سبيل المثال:
أصغر مقدار مولي في المركب هو الأكسجين بنسبة 0,53 مول
6.28 مول/0.53 مول = 11.83
0.53 مول/0.53 مول = 1
15.98 مول/0.53 مول= 30.15
قرب القيم المولية والجزيئية لأرقام صحيحة ومنطقية
ستصبح هذه الأرقام هي الأرقام السفلية في الصيغة التجريبية العامة لذلك عليك تقريبها لأقرب رقم صحيح أي من دون أعداد عشرية يمكنك كتابة الصيغة التجريبية العامة بعد إيجاد هذه الأرقام.
على سبيل المثال الصيغة الجزيئية أو المولية :
ستكون الصيغة التجريبية العامة : C12OH30
11.83 = 12
1 = 1
30.15 = 30
كيفية فهم الصيغ الكيميائية المتنوعة :
عليك أولاً فهم الصيغة التجريبية العامة :
تمنحك الصيغة التجريبية العامة لكل المركب معلومات عن النسبة بين ذرة وأخرى في المركب وهي لا تقدم أية معلومات عن عدد الذرات الموجودة في الجزيء الواحد بالضبط كذلك فإنها تفشل في تقديم معلومات كافية عن بنية وتركيب الذرات وروابطها المتنوعة في هذا الجزيء أو في هذا المركب
اعرف ما تقدمه الصيغة الجزيئية أو المولية من معلومات وتفاصيل بشكل جيد :
تخفق الصيغة الجزيئية أو المولية في تقديم معلومات عن بنية وتركيب الجزيء وروابطه الكيميائية كالصيغة التجريبية العامة لكنها تمنحك تفاصيلًا وبيانات هامة وضرورية عن قيم و أعداد كل ذرة في الجزيء بعكس الصيغة التجريبية العامة ؛ كلا الصيغتين ترتبطان بنسبة رقم صحيح وثابت.
افهم التمثيل البنيوي جيداً:
يمنحك التمثيل البنيوي والهيكلي والصياغة العامة للجزيئات والمركبات معلومات أكثر من الصيغة الجزيئية العامة دائماً، وهو يعطي معلومات عن بنية الجزيء وتركيبه الكيميائي وترابطه بالإضافة لتوضيح عدد الذرات فيه بالإضافة لكتلتها .. هذه المعلومات والمعطيات هامة جداً وضرورية لفهم كيفية تفاعل الجزيء والمركب مع الجزيئات الآخرى أو مع البيئة المحيطة به .
إليك بعض الأفكار المفيدة جداً والضرورية في الصيغة الجزيئية أو المولية:
اقرأ المسألة (أو المعطيات والمعلومات ) بعناية وبتركيز جيد وذلك لفهم المسألة جيداً وفهم المطلوب منكَ وكما يقولون إن فهم السؤال هو نصف الحل ويرشدك إلى الحل بشكل كامل وصحيح.
إليك بعض التحذيرات والنصائح الهامة الصيغة الجزيئية أو المولية :
لا تقم بالخلط وعد التمييز بين الصيغة الجزيئية أو المولية والتجريبية أبداً
لأن ذلك سيقودك إلى نتائج غير صحيحة وسيفشلك ..
إليك الأشياء اللازمة التي ستحتاج إليها من أجل إيجاد الصيغة الكيميائية العامة وحل المسائل أيضاً وخصوصاٍ في الامتحانات والاختبارات :
- الجدول الدوري للعناصر: يعد مهم جداً لأخذ المعلومات الازمة منه لأن حفظه صعب ومعقد جداً وينسى بشكل فوري وذلك لتوفير الوقت والجهد
- آلة حاسبة للقيام بحساب وإخراج النتائج بشكل صحيح وسريع من دون إضافة الوقت والجهد
- قلم رصاص: كن أجل الحل ومسح الحل الخاطئ إن وجد بالإضافة إلى المحافظة على نظافة الورقة وترتيبها عند استخدام قلم الرصاص بالإضافة لتوفير الوقت
- ورق: وأخيراً استخدم الورق الجيد من أجل الحل أنصحك بالورق الأبيض غير المخطط ذو سماكة عالية ..
ختاماً: لإيجاد الصيغة الجزيئية أو المولية دور كبير وهام في علم الكيمياء وفي مجالات وتخصصاته المتنوعة وخصوصاً في حل المسائل المتعلقة بالأملاح والحموض والأسس وغيرها الكثير.
أتمنى أن أكون قد قدمت الفائدة العلمية عن كيفية إيجاد الصيغة الجزيئية أو المولية والتجريبية بطريقة واضحة وسهلة بالإضافة لبعض النصائح والملاحظات الهامة ..
لاتنسوا الإعجاب بموقعنا المتواضع ومشاركتنا أرآكم في قسم التعليقات في الأسفل لدعمنا والمساهمة في نشر المعلومات والمواضيع الهامة والمفيدة دمتم في أمان وطاعة الله والسلام عليكم ورحمة الله وبركاته