
كيفية حساب الكتلة الذرية ، سنتعرف في هذا الدرس إن شآءالله عن:
- مقدمة عامة عن حساب الكتلة الذرية .
- تعريف الكتلة الذرية للعناصر والمركبات الكيميائية.
- كيفية حساب الكتلة الذرية.
- كيفية قراءة الكتلة الذرية من الجدول الدوري.
- كيفية حساب العدد الذري.
- كيفية حساب العدد الكتلي.
- كيفية حساب عدد الإلكترونات والنيوترونات والبروتونات وعلاقتها مع العدد الذري والكتلي.
- مسائل وتمارين متنوعة.
- بعض المعلومات والأفكار الهامة والمفيدة لحل المسائل.
- بعض نظائر العناصر.
- أهمية الجدول الدوري في حل المسائل وكيفية إيجاد القراءات منه.
- الأدوات اللازمة لحل مسائل الكتلة الذرية والعدد الذري والكتلي في علم الكيمياء.
مقدمة عامة عن الكتلة الذرية
تعد معرفة الكتلة الذرية للعناصر والمركبات الكيميائية مهم جداً في علم الكيمياء وخصوصاً في حل المسائل وفي موازنة المعادلات الكيميائية ومسائلها بالإضافة لمعرفة كتلة ووزن المركبات والمواد الكيميائية التي تساهم في معرفة الحجم والكثافة وغيرها من المعلومات الهامة لفهم وإتقان علم الكيمياء
تعريف الكتلة الذرية
تعرف الكتلة الذرية أو الكتلية على أنها مجموع عدد البروتونات وعدد النيوترونات وعدد الإلكترونات في ذرة أو في جزيء واحد.
لكن كتلة الإلكترونات صغيرة جداً لدرجة أنها تعد غير جديرة بالذكر ويتم التغاضي عنها عند حساب الكتلة والوزن .
يستخدم هذا المصطلح أيضًا لحساب “متوسط الكتلة الذرية” لكل نظائر العناصر ونظائر المركبات، لكن هذا غير دقيق لأن التعريف الثاني هو في الحقيقة لمتوسط الكتلة الذرية النسبية أو الوزن الذري للعنصر.
الوزن الذري يضع في الحسبان متوسط كُتَل نظائر العنصر الموجودة في الطبيعة.
يحتاج الكيميائيون إلى التفريق بين هذين النوعين للكتلة الذرية حتى يبنون استنتاجاتهم على هذا الأساس؛ لأن قيمة كتلة ذرية غير صحيحة يمكن أن تؤدي على سبيل المثال إلى نتيجة غير صحيحة في التجارب.
إيجاد قراءات الكتلة الذرية من الجدول الدوري:
افهم طريقة عرض الكتلة الذرية:
يمكن قياس الكتلة الذرية التي تمثل كتلة أو جزيء ما بنظام الوحدات الدولية لقياس الكتل أو ما يرمز له بـ (SI)، وهي الجرامات والكيلوجرامات وغير ذلك.
لكن بما أن الكتلة الذرية تكون صغيرة للغاية عندما توضع بهذه الوحدات، فهي عادةً يُعبَّر عنها بوحدة الكتل الذرية (يرمز لها اختصارًا في العادة بالحرف “u” أو “amu”)، ويساوي القياس المعياري لوحدة كتلة ذرية واحدة 1/12 من كتلة نظير ذرة الكربون-12.
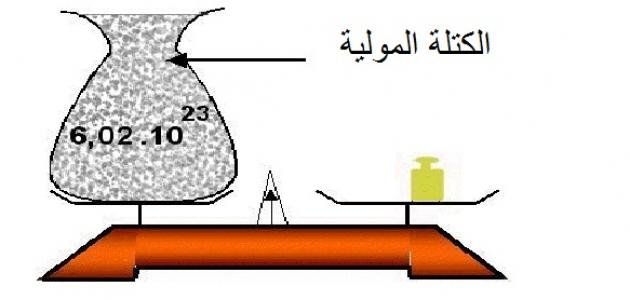
تشير وحدة الكتلة الذرية إلى كتلة مول واحد من عنصر أو جزيء معين بالجرامات”.
هذه خاصية مفيدة جدًا عند تطبيق الحسابات عمليًا لأنها تتيح التحويل بسهولة بين كتلة ومولات كمية معطاة من الذرات أو الجزيئات من نفس النوع.

حدد مكان الكتلة الذرية للعنصر من الجدول الدوري
تُدرج معظم الجداول الدورية القياسية للعناصر الكتل الذرية (الأوزان الذرية) لكل عنصر.
تُكتَب هذه القيمة في معظم الأحيان على صورة رقم أسفل مربع العنصر على الطاولة، تحت رمزها الكيميائي المكون من حرف أو حرفين.
عادةً يُكتب هذا الرقم كعدد عشري لا كعدد صحيح.
لاحظ أن الكتلة الذرية النسبية المدرجة على الجدول الدوري تمثل متوسط قيم العنصر المذكور.
للعناصر الكيميائية نظائر مختلفة، وهي عبارة عن التركيبات الكيميائية المختلفة في الكتلة بسبب زيادة أو نقص نيوترون أو أكثر في نواة الذرة بالتالي تمثل الكتلة الذرية النسبية المدرجة في جدول العناصر والمركبات قيمة مناسبة كمتوسط الكتلة لذرات أحد العناصر، لكن ليس كقيمة كتلة ذرة منفردة من العنصر.
تستخدم الكتل الذرية النسبية كما هي على الجدول الدوري لحساب الكتل المولية للذرات والجزيئات. عندما تُمَثّل الكتلة الذرية بوحدة الكتل الذرية amu كما في جدول العناصر الدوري، تعتبر عمليًا ليس لها وحدة، لكن من خلال ضربها ببساطة في 1 جرام/مول، نحصل على كمية معقولة للكتلة المولية للعنصر؛ وهي كتلة مول واحد (بالجرامات) لذرة واحدة حيث لا تتغير قيمتها لأنها مضروبة بالعدد١ .
على سبيل المثال:
الكتلة الذرية للحديد هي 55.847، مما يعني أن مولًا واحدًا من ذرات الحديد يزن 55.847 جرامًا.
افهم أن قيم الجدول الدوري هي متوسط الكتلة الذرة للعنصر كما ذكرنا، الكتل الذرية النسبية المدرجة لكل عنصر في الجدول الدوري هي متوسط قيم كل نظائر العنصر.
هذه القيمة المتوسطة مهمة لكثير من الحسابات العملية، مثل الكتلة المولية لجزيء مؤلف من عدة ذرات.
لكن عند التعامل مع ذرات منفردة، يكون الرقم أحيانًا غير كافٍ.
بما أن القيم الموجودة في الجدول الدوري هي متوسط أنواع مختلفة من النظائر، فهي ليست قيمة دقيقة ككتلة ذرية لأي ذرة منفردة.
يجب حساب الكتل الذرية للذرات المنفردة من خلال أخذ العدد الدقيق للبروتونات والنيوترونات في هذه الذرة في الحسبان.
حساب الكتلة الذرية لذرة واحدة
جد العدد الذري للعنصر أو النظير:
العدد الذري هو عدد البروتونات في العنصر وهو ثابت دائمًا.
على سبيل المثال:
كل ذرات الهيدروجين – ولا شيء غير الهيدروجين – بها بروتون واحد.
العدد الذري للصوديوم هو جرام11 لأن نواتها تحتوي على 11 بروتون ، والعدد الذري للأكسجين هو 8 مما يعني أن نواة ذراته بها 8 بروتونات أي دائماً في كل ذرة عدد الإلكترونات يساوي عدد البروتونات ويساوي العدد الذري ، بينما العدد الكتلي هو كتلة النواة أي مجموع عدد البروتونات والنيوترونات أو مجموع عدد الإلكترونات والنيوترونات أو مجموع العدد الذري مع عدد النيوترونات.
يمكنك إيجاد العدد الذري لأي عنصر في الجدول الدوري، حيث يوجد في كل الجداول الدورية القياسية، مكتوب فوق رمز العنصر الكيميائي المكون من حرف أو حرفين قيمة العدد الذري .
هذا العدد موجب صحيح دائمًا.
لاحظ أن العدد الذري لعنصر لا يؤثر بأي شكل مباشر على كتلته الذرية النسبية المدرجة في الجدول الدوري.
مع ذلك هناك عناصر – خاصةً الموجودة في أعلى الجدول – تجعل الأمر يبدو كما لو كانت الكتلة الذرية هي ضعف العدد الذري، لكن هذه ليست قاعدة ولا يمكن حساب الكتلة الذرية لعنصر من خلال مضاعفة عدده الذري.
جد عدد نيوترونات الذرة :
يختلف عدد النيوترونات بين ذرات العنصر الواحد. صحيح أن ذرتين تحتوي كل منهما على العدد نفسه من البروتونات وعدد مختلف من النيوترونات هما من نفس النوع، لكنها نظائر مختلفة لنوع العنصر
على عكس عدد البروتونات الذي لا يتغير أبدًا، تتنوع أعداد النيوترونات في ذرات نوع معين من العناصر كثيرًا لدرجة توجب التعبير عن متوسط قيمة الكتلة الذرية بقيم عشرية تمثل أرقامًا واقعة بين عددين صحيحين.
تُحدّد عدد النيوترونات عن طريق الاسم الخاص بنظير العناصر
على سبيل المثال:
كربون-14 هو نظير مشع موجود بصورة طبيعية من الكربون-12.
ستصادف كثيرًا نظائر مُعرّفة بعدد أعلاها يسبق رمز العنصر: 14C.
تُحسَب عدد النيوترونات من خلال طرح عدد البروتونات من عدد النظير أو من طرح عدد الإ:
14 – 6 = 8 نيوترونات.
لنقل أن ذرة الكربون التي نتعامل معها تحتوي على ستة نيوترونات (12C).
هذا هو أكثر نظائر الكربون انتشارًا بدرجة كبيرة جدًا، والذي يمثل مقدار 99% من جميع ذرات الكربون.
لكن حوالي 1% من ذرات الكربون بها 7 نيوترونات (13C)، وكذلك توجد بكمية قليلة جدًا ذرات كربون أخرى تحتوي على أقل من 6 أو أكثر من 7 نيوترونات.
اجمع عدد البروتونات والنيوترونات : النتيجة هي الكتلة الذرية.
لا تقلق بخصوص الإلكترونات التي تدور حول النواة لأن كتلتها عندما تتجمع قليلة جدًا جدًا، ولن تشكل فرقًا في الإجابة في معظم الحالات العملية.
ذرة الكربون التي معنا تحتوي 6 بروتونات + 6 نيوترونات = 12.
الكتلة الذرية الخاصة بذرة الكربون المعنية هي 12. أما لو كان نظير “كربون-13” مثلًا، سنفهم من هذا أنها تحتوي على 6 بروتونات + 7 نيوترونات = وزن ذري قيمته 13.
وزن كربون-13 الحقيقي هو 13,003355 ، حتى مع خانات عشرية أكثر تزيد دقة الوزن لأنه تحدد بالتجارب المعملية.
الكتلة الذرية قريبة جدًا من عدد نظير العنصر، وعندما نحتاج إلى حسابات بسيطة كالتي نجريها، يتساوى عدد النظير مع الوزن الذري. عندما يتحدد الوزن بالتجارب، تزيد الكتلة الذرية عن عدد النظير قليلًا بسبب ما تضيفه كتلة الإلكترونات الضئيلة للغاية.
حساب الكتلة الذرية النسبية (الوزن الذري) لعنصر
حدد النظير المُمَثَّل في العينة :
يحدد الكيميائيون الكميات النسبية للنظائر في عينة معطاة من خلال استخدام أداة خاصة تسمى مطياف الكتلة.
لكن بالنسبة لكيمياء في مستوى الطالب، تتوفر هذه المعلومات للطلاب في الاختبار في صورة قيم مؤكدة من المؤلفات العلمية.
فيما يخص أهدافنا من الحساب، لنقل أننا نتعامل مع النظيرين كربون-12 وكربون-13.
حدد الوفرة النسبية لكل نظير في العينة. تظهر بين ذرات العنصر الواحد نظائر كل منها مختلف في كمية تكرره، وتتمثل هذه الكميات غالبًا بنسب مئوية. هناك نظائر واسعة الانتشار، ونظائر أخرى نادرة جدًا لدرجة أنها في بعض الأحيان تكاد تغيب عن التمييز.يمكن تحديد هذه المعلومات من خلال مطياف الكتلة أو كتاب مرجعي.
لنقل هنا أن وفرة الكربون-12 هي 99% وكربون-13 منتشر بنسبة 1%. هناك نظائر كربون أخرى موجودة في العالم، لكنها موجودة بكميات ضئيلة للغاية حتى أنها يمكن تجاهلها في بعض الأحيان، مثل في حالة هذا المثال.
اضرب الكتلة الذرية لكل نظير في كميته في العينة. يعني في النسبة المئوية لوفرة هذا النظير (تُكتَب في صورة عدد عشري).
لتحويل نسبة مئوية إلى عدد عشري، اقسمها ببساطة على 100.
يجب أن يساوي مجموع النسب المئوية بعد التحويل 1.
تحتوي عينتنا على كربون-12 وكربون-13.
إذا توفر كربون-12 بنسبة 99% في العينة وكربون-13 بنسبة 1% منها اضرب 12 (الكتلة الذرية لكربون-12) في 0,99، و13 (الكتلة الذرية لكربون-13) في 0,01.
تحوي الكتب المرجعية النسب المئوية لمقدار وجود نظير ما وفقًا لكميات كل النظائر الموجودة للعنصر. توجد هذه المعلومات في معظم كتب الكيمياء المدرسية وفي جميع المراحل في جدول في نهاية الكتاب. يمكن أيضًا تحديد مقدار النظائر في العينة التي تُختَبَر عن طريق استخدام مطياف كتلة ألخ…
قم بجمع النواتج:
احسب مجموع نواتج الضرب الذي أجريته في الخطوة السابقة لتجد الكتلة الذرية النسبية للعنصر – وبمعنى آخر:
متوسط قيمة الكتل الذرية لنظائر العنصر
تستخدم هذه القيمة عند التحدث عن عنصر ما بصورة عامة وليس عن نظير معين له.
تطبيقًا على مثالنا السابق:
12 × 0,99 = 11,88 لكربون-12، و 13 × 0,01 = 0,13 لكربون-13.
الكتلة الذرية النسبية للمثال هي 11,88 + 0.13 = 12,01.
العدد الكتلي هو مجموع عدد البروتونات والنيوترونات
أو مجموع عدد البروتونات والإلكترونات
أو مجموع العدد الذري مع عدد النيوترونات
الإلكترونات ذو شحنة سالبة
والبروتونات ذات شحنة موجبة
والنيوترونات ذات شحنة معتدلة
بالتالي الذرة معتدلة الشحنة أي معتدلة كهربائياً
والنواة وهي مجموع عدد النيوترونات والبروتونات ذات شحنة موجبة
الأشياء التي ستحتاج إليها في حساب الكتلة الذرية والعدد الذري في المسائل :
- كتاب مرجعي في الكيمياء
- آلة حاسبة
- الجدول الدوري.

شاهد ايضاً الصيغة الجزيئية أو المولية.
أتمنى أن أكون قد قدمت الفائدة العلمية عن كيفية حساب الكتلة الذرية للعناصر والمركبات الكيميائية بطريقة سهلة وواضحة من دون إطالة أو تقصير في المعلومات مع كيفية حساب العدد الذري والكتلي وعدد الإلكترونات والنيوترونات والبروتونات في الذرة وعلاقتهما مع بعضهما البعض مع ذكر بعض المعلومات والأفكار العلمية الهامة والمفيدة.
لا تنسوا الإعجاب بموقعنا المتواضع ومشاركتنا أرآكم في قسم التعليقات في الأسفل لدعمنا والمساهمة في نشر المعلومات والمواضيع الهامة والمفيدة لا تنسونا من صالح دعائكم
دمتم في أمان الله والسلام عليكم ورحمة الله.
شاهد ايضاً كيفية موازنة المعادلات الكيميائية 2023.










