ستتعرف في هذا الدرس إن شآءالله عن:
- مقدمة عامة عن التركيز المولي والتركيز الكتلي في عام الكيمياء
- تعريف التركيز المولي
- تعريف التركيز الكتلي
- العلاقة بين التركيز المولي و التركيز الكتلي
- أهمية حساب التركيز في علم الكيمياء
- القانون العام لحساب عدد المولات
- كيفية حساب واستنتاج الكتلة المذابة والكتلة الجزيئية المستخدمة في المحلول
- أمثلة متنوعة وشاملة غلى التركيز المولي والتركيز الكتلي مع العلاقة بينهما وكيفية استنتاج قيمة عدد المولات والكتل المذابة والمولية في المسائل
مقدمة عامة عن العلاقة بين التركيز المولي والتركيز الكتلي :
للتعرف على العلاقة بين التركيز المولي والتركيز الكتلي يجب بداية التعرف على تعريف وقانون كل من التركيز المولي والتركيز الكتلي لمعرفة العلاقة بينهم ومعرفة أهمية وفوائد كل منها في مسائل الكيمياء
تعريف التركيز المولي
التركيز المولي هو عدد مولات المادة المذابة في وحدة الحجوم من المحلول؛ أي كم عدد المولات التي تحتويها واحدة الحجم ، مثلاً الميليمتر مكعب أو اللتر كم يحتوي عدداً من المولات ويشار إليه بمصطلح ( المولارية ) ويقاس بوحدة mol / L أي أن عدد المولات المذابة في لتر واحد من المحلول وهذه الوحدة تكافئ المولية ويرمز لها ب M
مثال: تم تحضير محلول بإذابة (0.6) مول من كبريتات البوتاسيوم في الماء فأصبح حجم المحلول (600) لتر، احسب التركيز المولي لهذا المحلول؟
الحل: التركيز المولي= عدد المولات المذابة * حجم المحلول التركيز المولي = 0.6 * 600 = 360 مول/لتر

تعرف على علم الكيمياء
تعريف التركيز الكتلي :
التركيز الكتلي هو عدد غرامات المادة المذابة الموجودة في حجم مقداره ليتر من المحلول أي كمية أو مقدار المادة المستخدمة في كل ليتر واحد من المحلول ، ووحدة قياسه (غرام / مول) وهي تعبر عن عدد الغرامات المذابة في لتر واحد من المحلول المستخدم ، ويعبر عن قانون التركيز المولي من خلال القانون التالي علما أن وحدة قياس كتلة المادة المذابة mهي غرام أو ميلي غرام في بعض الحالات ، بينما وحدة قياس حجم المحلول V هي اللتر وفي بعض الأحيان نستخدم المتر المكعب عندما تكون الكميات والمقادير كبيرة نوعاً ما …
قانون التركيز الكتلي :
مثال: تم إذابة مادة حمض الخل في الماء أي عملية تمييه بواسطة الماء..لنحصل على محلول حجمه (700 مليلتر ) علما أن كتلة أو مقدار حمض الخل المستخدم يساوي (g3m= غرامات) أوجد التركيز الكتلي لهذا المحلول?
الحل: بداية يجب تحويل حجم المحلول من (مليلتر) إلى (لتر) إذا (700 مل) = 0.7 لتر أي نقوم بتقسيمه على ١٠٠٠ ؛ لأم كل ١ ليتر = ١٠٠٠ ميليلتر
قانون التركيز الكتلي:
العلاقة بين التركيز المولي والتركيز الكتلي يمكن استنتاج العلاقة بين التركيز المولي والتركيز الكتلي لأي محلول مستخدم من خلال القوانين الفيزيائية التالية:
لكن بداية يجب التذكير أن العلاقة بين الكتلة وعدد المولات هي (الكتلة = عدد المولات الكلية × الكتلة المولية الجزيئية الكلية للمادة المذابة ) وقد وضحنا سابقاً أن :
التركيز الكتلي للمحلول = التركيز المولي × الكتلة المولية أو الجزيئية للمادة المذابة
إذن العلاقة بين التركيز المولي للمحلول والتركيز الكتلي للمحلول ذاته تتلخص خلال القانون التالي (التركيز الكتلي للمحلول = التركيز المولي للمحلول × الكتلة المولية أو الكتلة الجزيئية المذابة في المادة ).
أمثلة متنوعة عن حساب التركيز والحجوم والكتل وعدد المولات :
المثال الأول:
محلول لحمض الأسيتيك مثلاً تركيز هذا الحمض يساوي إلى (30 غراماً/ لتر) أي C = 30 gr/L من واحدة هذا التركيز نلاحظ أن هذا التركيز هو تركيز كتلي ولو وجد المول في الواحدة لكان التركيز هو تركيز مولي ..
والمطلوب :حساب عدد المولات الحمض الموجودة في (٦00 ميليلتر)، علماً أن الكتلة المولية لحمض الأستيك تساوي (٥0 غراماً/ لتر)
الحل: أولاً :
نحول حجم المحلول من ميليلتر إلى لتر بتقسيمها على. ١٠٠٠ ٦0٠ مليلتر = 0.٦ لتر
ثانياً:
التركيز الكتلي للمحلول = التركيز المولي للمحلول × الكتلة المولية لحمض الأستيك 30 = التركيز المولي × 50
التركيز المولي = 30/50 = 0.6 مول/ على اللتر
ثالثاً: التركيز المولي للمحلول = عدد المولات للحمض × حجم هذا المحلول بشكل كامل
0.٦ = عدد المولات × 0.٦ عدد المولات = 0.٦ /0.٦ = 1 مول وهو المطلوب
المثال الثاني:
احسب كتلة كبريتات المغنيسيوم التي تلزم لتحضير (4 لترات … معلومة حجم ) من محلول تركيزه (0.02 مول / لتر من هذه الواحدة نستنتج أن هذا التركيز هو تركيز مولي )، علما أن الكتلة المولية أو الجزائية لكبريتات المغنيسيوم (120 غراماً/لتر).
الحل:
أولا: التركيز كتلي للمحلول = التركيز المولي لنفس المحلول × الكتلة المولية أو الجزيئية للمادة المذابة = 0.02 × 120 = 2.40 غرام / لتر
ثانيا: التركيز الكتلي للمحلول = كتلة المادة المذابة أي المستخدمة في المحلول × حجم المحلول
2.4 = كتلة كبريتات المغنيسيوم المستخدمة × 4L
كتلة كبريتات المغنيسيوم = 2.4/4 = gr 0.6 غرام
نتحقق دائماً من تجانس الوحدات وتجانسها
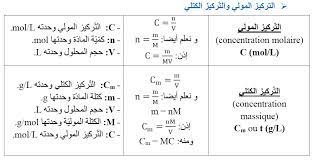
القوانين الفيزيائية المستخدمة في التركيز المولي والتركيز الكتلي :
- Cmol/L= n/ V التركيز المولي
- Cgr/L= m/V التركيز الغرامي
- العلاقة بين التركيزين
Cmol/L × M = Cgr/L
حيث :M هي الكتلة المولية أو الجزيئية وتحسب إن لم ترد في نص المسألة من الأوزان الذرية لكل ذرة وجزيء موجود في الصيغة الكيميائية للمحلول أو الكتلة المذابة ..
ختاماً:
لحساب التركيز المولي والتركيز الكتلي وحساب عدد المولات والكتل بأنواعها أهمية كبيرة ودور فعال في علم الكيمياء بشكل عام وفي مسائل الكيمياء الاعضوية بشكل خاص .
أتمنى أن أكون قد قدمت الفائدة العلمية عن كيفية حساب التركيز المولي والتركيز الكتلي وعدد المولات والحجوم والكتابة المتنوعة المستخدمة في المحلول..
لاتنسوا الإعجاب بموقعنا المتواضع ومشاركتنا أرآكم في قسم التعليقات في الأسفل لدعمنا والمساهمة في نشر المعلومات والمواضيع الهامة والمفيدة
دمتم في أمان وطاعة الرحمن والسلام عليكم ورحمة الله وبركاته .
شاهد ايضاً علم الكيمياء 2024